??? 12月7日,國家藥監(jiān)局發(fā)布新修訂《醫(yī)療器械經(jīng)營質(zhì)量管理規(guī)范》(以下簡稱《規(guī)范》),以適應(yīng)新形勢下醫(yī)療器械經(jīng)營監(jiān)管與質(zhì)量管理工作需要,規(guī)范醫(yī)療器械經(jīng)營活動,保障醫(yī)療器械產(chǎn)品質(zhì)量安全。《規(guī)范》自2024年7月1日起施行。
行業(yè)·政策動態(tài)
1.國家衛(wèi)生健康委、國家中醫(yī)藥局、國家疾控局聯(lián)合印發(fā)《醫(yī)療監(jiān)督執(zhí)法工作規(guī)范(試行)》,旨在規(guī)范醫(yī)療監(jiān)督執(zhí)法工作,維護醫(yī)療秩序。其中,藥品、醫(yī)療器械臨床使用監(jiān)督執(zhí)法主要采取以下方法:一是查看藥品、醫(yī)療器械管理組織的設(shè)立文件和管理制度;二是抽查藥品、醫(yī)療器械的購買、使用、不良事件監(jiān)測與報告等資料;三是抽查醫(yī)療用毒性藥品、麻醉藥品和精神藥品的購買、儲存、使用、登記、處方保存、回收、銷毀等資料;四是抽查抗菌藥物的采購、分級使用、處方權(quán)管理等資料;五是抽查臨床使用大型醫(yī)療器械以及植入和介入醫(yī)療器械的使用記錄。中醫(yī)藥服務(wù)監(jiān)督執(zhí)法主要抽查中醫(yī)醫(yī)療機構(gòu)內(nèi)中藥飲片的采購、驗收、保管、調(diào)劑、臨方炮制、煎煮等管理情況;抽查膏方的處方開具、制備管理、臨床使用等是否符合規(guī)定。
2.國家藥監(jiān)局藥品審評中心(CDE)就《化學(xué)仿制藥參比制劑目錄(第七十七批)》(征求意見稿)公開征求意見,涉及利魯唑口服混懸液等品種。
3.CDE就《腦膜炎球菌疫苗臨床試驗技術(shù)指導(dǎo)原則(征求意見稿)》(以下簡稱《征求意見稿》)公開征求意見。《征求意見稿》首先概述了腦膜炎球菌及其所致疾病的特點,隨后基于腦膜炎球菌疫苗臨床試驗的特殊性提出了試驗設(shè)計和實施的總體考慮。在此基礎(chǔ)上,重點對于早期探索性臨床試驗與確證性臨床試驗的具體設(shè)計與評價指標進行了相應(yīng)論述,包括免疫持久性/加強免疫和安全性研究的關(guān)注點,旨在為上市許可提供充分的有效性(免疫原性)和安全性數(shù)據(jù)以評估疫苗的獲益-風(fēng)險,并對上市后研究提出了要求。
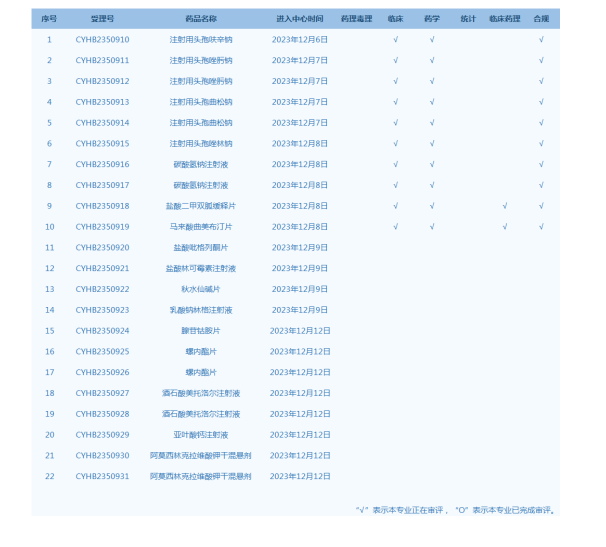
4.CDE網(wǎng)站公示22個仿制藥一致性評價任務(wù),涉及注射用頭孢呋辛鈉等品種(截至12月12日)。
產(chǎn)品研發(fā)·上市信息
1.國家藥監(jiān)局發(fā)布3期藥品批準證明文件送達信息,共包括206個受理號,涉及阿斯利康投資(中國)有限公司等企業(yè)(截至12月12日)。

2.CDE承辦受理67個新藥上市申請,包括RJMty19注射液等藥品(截至12月12日)。

3.康寧杰瑞制藥宣布,JSKN033用于治療HER2表達的晚期或轉(zhuǎn)移性實體瘤的Ⅰ/Ⅱ期臨床試驗在澳大利亞獲批。
4.海創(chuàng)藥業(yè)發(fā)布公告稱,公司自主研發(fā)的尿酸鹽陰離子轉(zhuǎn)運體1(URAT1)抑制劑HP501緩釋片用于治療痛風(fēng)相關(guān)的高尿酸血癥的Ⅱ期臨床試驗申請正式獲得美國食品藥品管理局(FDA)批準。
5.百奧泰發(fā)布公告稱,收到美國FDA簽發(fā)的關(guān)于BAT1706(貝伐珠單抗注射液生物類似藥)上市批準的通知,適應(yīng)證包括轉(zhuǎn)移性結(jié)直腸癌,非小細胞肺癌,成人復(fù)發(fā)性膠質(zhì)母細胞瘤,轉(zhuǎn)移性腎細胞癌,持續(xù)性、復(fù)發(fā)性或轉(zhuǎn)移性宮頸癌,上皮性卵巢癌,輸卵管癌或原發(fā)性腹膜癌。
6.神曦生物宣布,其自主研發(fā)的AAV基因治療產(chǎn)品NXL-004用于治療惡性膠質(zhì)瘤適應(yīng)證獲美國FDA授予孤兒藥資格。
醫(yī)藥企業(yè)觀察
1.步長制藥發(fā)布公告稱,公司全資子公司保定天浩制藥有限公司與鄭州深藍海生物醫(yī)藥科技有限公司(以下簡稱深藍海醫(yī)藥)簽訂技術(shù)服務(wù)(委托)合同,委托深藍海醫(yī)藥在國內(nèi)GCP基地醫(yī)院開展比較BC003和新活素治療急性失代償性心力衰竭(ADHF)患者的有效性及安全性的多中心、隨機、雙盲、陽性對照的Ⅲ期臨床研究。
2.康寧杰瑞與特寶生物共同宣布,雙方已就康寧杰瑞自主研發(fā)的KN056或KN069(以下簡稱授權(quán)產(chǎn)品)的權(quán)益許可簽署合作協(xié)議。根據(jù)協(xié)議條款,授權(quán)產(chǎn)品許可的地理區(qū)域為中國大陸地區(qū),許可適應(yīng)證領(lǐng)域為非酒精性脂肪肝(NASH)的預(yù)防和/或治療。特寶生物將獨家負責(zé)授權(quán)產(chǎn)品在許可范圍內(nèi)的臨床開發(fā)和商業(yè)化銷售,并向康寧杰瑞支付累計最高人民幣4.9億元的權(quán)益付款(包括首付款和里程碑款)及占凈銷售額一定比例的銷售提成。康寧杰瑞保留授權(quán)產(chǎn)品在許可范圍以外的所有權(quán)益。
3.西比曼生物宣布與阿斯利康就C-CAR031簽署聯(lián)合開發(fā)協(xié)議。C-CAR031是一種針對肝細胞癌(HCC)的自體抗磷脂酰肌醇蛋白聚糖3(GPC3)的裝甲型CAR-T療法。根據(jù)協(xié)議條款,西比曼生物和阿斯利康將在中國共同開發(fā)和商業(yè)化C-CAR031。西比曼生物將獲得一筆首付款,還將有資格獲得阿斯利康在中國以外地區(qū)獨立開發(fā)、生產(chǎn)和商業(yè)化AZD5851時的里程碑付款和全球開發(fā)的特許權(quán)使用費。
4.百利天恒宣布其全資子公司SystImmune和百時美施貴寶公司就BL-B01D1達成獨家許可與合作協(xié)議。BL-B01D1是一款潛在“first-in-class”EGFR/HER3雙特異性抗體偶聯(lián)藥物(ADC)。百時美施貴寶和SystImmune公司將在美國聯(lián)合開發(fā)并商業(yè)化BL-B01D1;SystImmune公司將保留其在中國大陸的獨家權(quán)益,而百時美施貴寶將獲得在全球其他市場的獨家許可。根據(jù)協(xié)議,百時美施貴寶將向SystImmune公司支付8億美元的首付款,和最高可達5億美元的近期或有付款;達成開發(fā)、注冊和銷售里程碑后,SystImmune公司將獲得最高可達71億美元的額外付款。雙方將共同承擔(dān)BL-B01D1的全球開發(fā)費用,并分享在美國市場的利潤和虧損。
藥品集中采購
1.廣東省藥品交易中心就《廣東聯(lián)盟阿莫西林等藥品集中帶量采購文件(征求意見稿)》公開征求意見。該省將對廣東聯(lián)盟阿莫西林等藥品集采和頭孢氨芐藥品集采協(xié)議期滿的81個藥品劑型進行集采,協(xié)議期內(nèi)的國家醫(yī)保談判藥品(含競價藥品)不列入本次集采范圍;氟比洛芬緩釋控釋劑型為獨家品種且已停產(chǎn),不列入本次集采范圍,采購周期內(nèi)不再掛網(wǎng)交易。
2.湖南省醫(yī)保局發(fā)布《關(guān)于開展第九批國家組織藥品集中采購部分品種第二備供企業(yè)遴選工作的通知》,8個產(chǎn)品、涉及41家企業(yè)可進行第二備供信息申報。
3.吉林省公共資源交易中心發(fā)布《關(guān)于開展吉林省公立醫(yī)療機構(gòu)藥品集中采購的公告》,吉林省將開展藥品集中采購,包括全省公立醫(yī)療機構(gòu)(含縣級及以上、國有企業(yè)等非營利醫(yī)療機構(gòu)、基層機構(gòu)),鼓勵其他醫(yī)療衛(wèi)生機構(gòu)參加藥品集中采購。采購藥品范圍是未在吉林掛網(wǎng)交易的藥品,且藥品注冊批件批準時間在2023年1月1日(含1日當天)后的藥品,但不包括藥品再注冊批準(含藥品補充批件)時間在2023年1月1日后的藥品。