2017醫療器械市場第一擊 經營企業要當心了
??????? 2017年2月14日,本應沉浸在玫瑰花濃情氛圍中的大眾,傍晚卻被金正男的死訊抓住了眼球;與之相比,國家食品藥品監督管理總局于同日發布的《關于醫療器械經營企業檢查結果的通告(2017年第22號)》吸睛能力自然減弱,但對于醫械經營同行們而言,果真如此嗎?
?
醫械監管思路怎么變?
?
當我們仔細閱讀相關內容后,留下最深刻印象的莫過于以下兩段:
?
“國家食品藥品監督管理總局已要求相關省級食品藥品監督管理局對上述企業的違法經營行為立案調查,依法嚴肅處理。情節嚴重的,責令停業,直至吊銷《醫療器械經營許可證》。構成犯罪的,依法追究刑事責任。對上述違法經營案件,國家食品藥品監督管理總局將進行督辦。”
?
“國家食品藥品監督管理總局已要求相關省級食品藥品監督管理局責令上述企業限期整改,并監督企業切實整改到位。”
?
“嚴肅”、“責令”、“吊銷”等這些詞兒對從業者形成了強烈的視覺沖擊,這次“國家隊”(國家食品藥品監督管理總局)又是什么套路?筆者分析后,試與讀者做出如下分享——
?
1、承上啟下,逐步推動
?
從業者肯定不會忘記2016年的112號公告(醫療器械經營企業自查),那無疑意味著“國家隊”要對整個行業開始摸底排查,完畢后,為了驗證各“省隊”“市隊”(各省市食品藥品監督管理局,下同)工作成果,馬上組織飛行檢查,對2016年的工作有了總結;接著選擇在2017農歷年初的節點發布該內容,在保證公告廣泛性和有效性的同時又起到警醒作用(恕筆者直言,大部分企業員工只有在2月14日之后,才基本進入工作狀態)。
?
2、監管層與從業者兩手抓
?
此公告涉及企業囊括廣東省(2家)、黑龍江省(1家)、北京市(1家)、吉林省(1家)、江蘇省(2家)、貴州省(1家)、天津市(2家)、上海市(2家)及湖南省(1家)等一系列醫藥、器械的經營大省,被飛檢省份的某些企業甚至存在十多項未符合要求的條款(《醫療器械經營質量管理規范》),對經營者的高壓態勢自不必說,但換個角度想,各“省隊、市隊”看到自己管轄區域內被飛檢的企業,有沒有羞愧和被打臉的感覺呢?所以,其實監管部門壓力也是不小的。那么,情人節之后,各地的監管態勢將如何轉變自不必說了。
?
3、飛檢重點開始轉向
?
若各位不太經常關注總局網站醫療器械的飛行檢查模塊的話,不妨現在進入國家藥監局網站看看2016年的飛檢公告,違規的大多為醫療器械生產企業,而此時飛檢矛頭卻突然轉向經營企業,方向重點自不必說。
?
再者,熟悉法規的讀者應該知道,針對醫療器械經營行業,國家做法大概如下:
?
2013-2014:開始逐步健全和規范法規內容
?
2015:法規推廣年
?
2016:摸底排查,源頭開刀(注冊和生產)
?
那么2017呢?必定開始優化行業結構。優化中一個重要的方向必定要淘汰,而飛行檢查又恰好是淘汰的有效手段,不是嗎?
?
醫械飛檢內容怎么變?
?
談完意圖,不妨聊聊檢查內容。
?
我們以CFDA關于益善生物技術股份有限公司等13家醫療器械經營企業檢查結果的通告(2017年第22號)中廣東合鑫生物科技有限公司的違規條款為例:
?
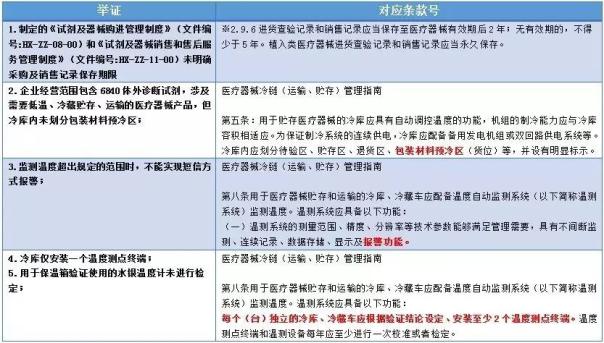



?
仔細分析該企業的違規條款,會發現如下特點:
?
1、核查趨向細致
?
被查企業中大多涉及了質量體系文件中很細化的內容,以不幸運的廣東合鑫生物科技有限公司為例,被查到“制定的《試劑及器械購進管理制度》(文件編號:HX-ZZ-08-00)和《試劑及器械銷售和售后服務管理制度》(文件編號:HX-ZZ-11-00)未明確采購及銷售記錄保存期限”。
?
從總局寫法來看,明顯是逐字逐句的看過質量管理制度才得出的結論,而在此之前,核查深度遠沒有如此,所以,“同一片天空,同一套制度”或“同一個省份,兩三套模板”也許要成為過去了。
?
2、冷鏈核查范圍廣
?
8家被嚴肅處理的企業中,2家因冷鏈管理不善都被下條款,且檢查范圍不只于《醫療器械經營質量管理規范》,還涉及易被忽略的《醫療器械冷鏈(運輸、貯存)管理指南》;比如某企業“未制定冷鏈管理的醫療器械在貯存、運輸過程中溫度控制的應急預案”這條違規項,是出自《醫療器械冷鏈(運輸、貯存)管理指南》第九條。所以,經營冷鏈產品的企業,要提防法規的“組合拳”哦。
?
3、凸顯“七大關鍵”
?
縱看這個公告,通篇把握了七個關鍵點,如下:
?
1.合法性:人員、倉儲與經營地址
?
2.制度規定:有沒有,是否實際
?
3.冷鏈與設備驗證與校準(注:校準的范疇不僅冷鏈設備,常溫計量設備也需要)
?
4.“四大記錄”:采購、驗收、出庫復核與銷售
?
5.首營資質審核:有沒有,是否記錄,是否可控
?
6.計算機系統:是否完善
?
7.不合格品處理:銷毀相關記錄
?
所以,個人認為,企業從這幾個點著手對自身開始整改,應該是個好方法。
?
行業發展總有亙古不變的套路——初期的懵懂,情人的蜜月,家庭的束縛。